高血压是心脑血管疾病的主要致病因素,也是慢性肾脏损伤的重要原因。高血压肾病(Hypertensive Renal Disease, HRD)是由原发性高血压导致的肾脏结构和功能的损害,是内科常见疾病之一,主要表现为蛋白尿增多、良性肾小球硬化、肾脏间质纤维化以及炎症细胞浸润,但其发病机制尚不明了。
肾脏的炎症反应和纤维化是HRD的两个主要病理特征,血管紧张素II(Angiotensin II, AngII)作为RAAS的主要成员,是HRD 进展的关键调节因子。研究显示,AngII可诱导肾脏过度分泌转化生长因子 β1(Transforming Growth Factor beta 1, TGF-β1)等细胞因子,促进成纤维细胞增殖和细胞外基质的合成,抑制细胞外基质的降解,加速肾脏纤维化的进程。以往的研究发现,TGF-β1通过介导Smad信号通路和MAPKs/NF-κB信号通路的活化来调控肾脏纤维化及肾脏炎症。MAP3K7,又名TAK1,是一种重要的丝裂原活化蛋白激酶分子,其激酶活性受到TGF-β1等多种细胞因子的调控。研究显示,活化的MAP3K7可磷酸化TGF-β1信号通路下游关键接头蛋白,在MAPKs/NF-κB的活化及炎症因子的产生过程中发挥着关键作用。然而,在HRD发生和发展过程中,MAP3K7是否同时参与调控TGF-β1介导的经典Smad信号通路及肾脏纤维化进展仍有待阐明。探讨 TGF-β1信号通路的调控机制,有利于进一步阐明高血压肾病的发病机制,为高血压肾病的药物研发提供理论依据。
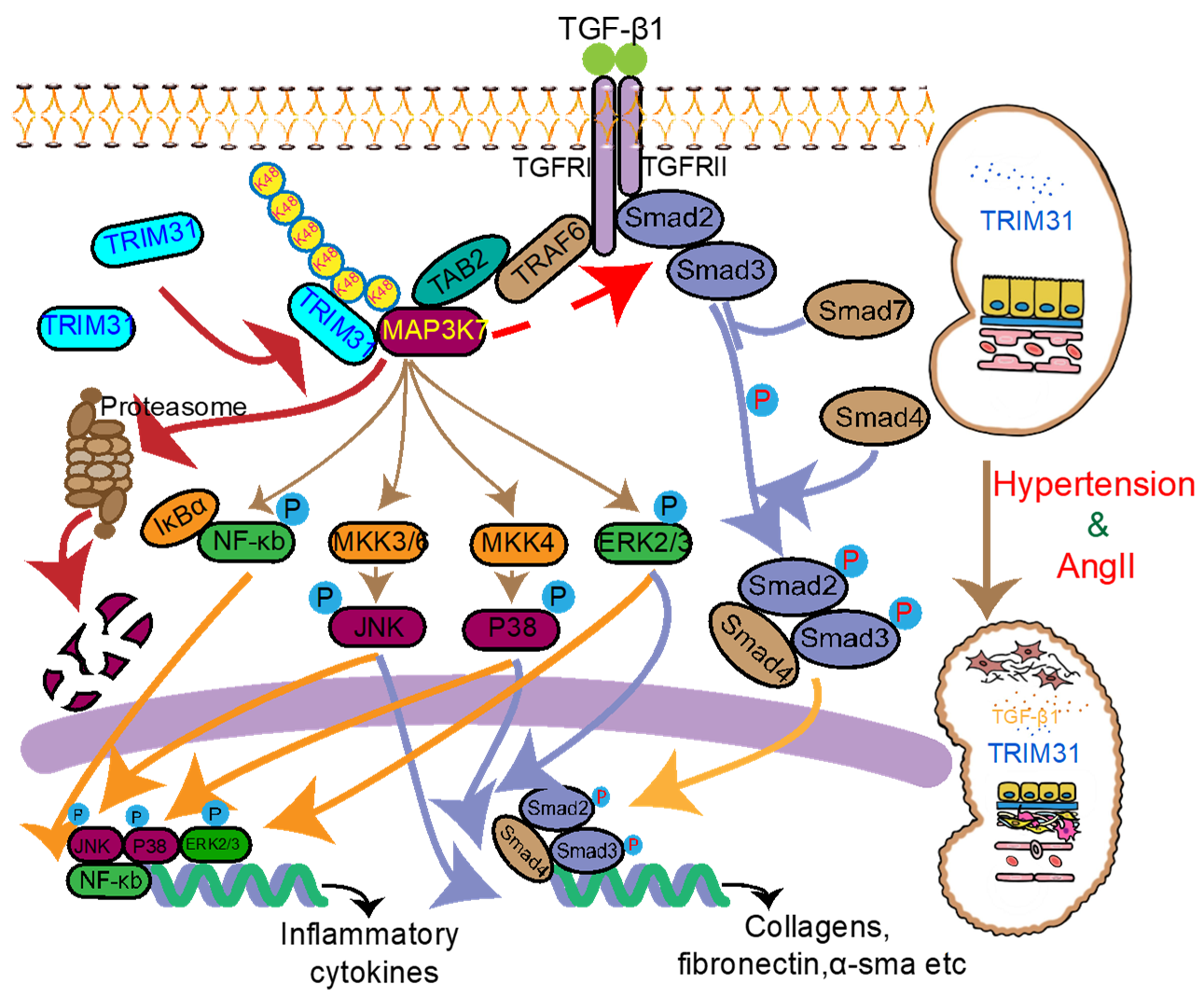
泛素化修饰是一种重要的蛋白质翻译后修饰,在多种疾病进展中发挥着关键作用。目前已发现多种E3泛素连接酶可调控高血压及其靶器官的损害,但针对HRD的泛素化修饰鲜有报道。TRIM31属于TRIM家族的一员,由锌指结构域、B-box结构域和卷曲螺旋结构域组成,是一种重要的E3泛素连接酶。既往研究表明,TRIM31在先天免疫应答、NLRP3炎症小体的激活、肠道菌群的组成以及肠道自噬中发挥着关键调控作用,TRIM31是否可通过其E3泛素连接酶功能影响HRD的疾病进展尚无报道。
2021年9月28日,来自山东大学齐鲁医院心血管重构与功能研究重点实验室张猛教授团队在国际权威期刊Cell Death and Differentiation(中科院一区,IF:15.828)上发表了题名为“The E3 ubiquitin ligase TRIM31 plays a critical role in hypertensive nephropathy by promoting proteasomal degradation of MAP3K7 in the TGF-β1 signaling pathway”的研究论文,阐明了E3泛素连接酶TRIM31通过靶向调控MAP3K7的泛素化修饰进而调控高血压肾病疾病进展的作用和机制。

首先,研究者在HRD患者的肾活检标本中发现,随着患者肾脏损伤和纤维化的进展,TRIM31的表达明显下调。为了模拟人类HRD的病理过程,研究者通过输注AngII成功构建了HRD小鼠模型,发现TRIM31的表达在AngII诱导的HRD小鼠肾脏中尤其是在肾小管中,同样发生了明显下调。在体外培养的人近端肾小管上皮细胞(HK2)中,TRIM31的表达随着AngII的刺激呈时间和浓度依赖性下降。这些体内和体外实验提示,HRD的进展可能与TRIM31在肾脏中的表达下调有关。

为了探索TRIM31在HRD中的作用,研究者构建了TRIM31基因敲除小鼠(TRIM31-/-),在此组小鼠和同窝野生型小鼠中分别泵入AngII持续6周以构建HRD小鼠模型。结果显示,AngII诱导的HRD小鼠血压明显升高,在造模结束前达到了高血压的水平,小鼠肾功能明显损伤,组织病理学检查显示肾脏纤维化和炎症反应。然而,TRIM31基因缺失不影响小鼠的基础血压和肾功能,亦不影响AngII诱导的小鼠血压升高,但TRIM31基因缺失加剧了AngII引起的小鼠肾功能损伤、肾脏滤过屏障损害、肾纤维化和炎症反应。为了进一步验证TRIM31与AngII诱导的HRD之间的因果关系,研究者通过AAV9-TRIM31病毒注射上调小鼠肾脏中TRIM31的表达,同样泵入AngII持续6周以构建HRD小鼠模型,发现TRIM31过表达可缓解AngII诱导的小鼠肾损伤、纤维化和炎症反应。这些结果提示,TRIM31介导了AngII引起的小鼠HRD的病理损害。

TGF-β1是高血压肾损伤和肾小管间质纤维化的关键因子,可通过促进细胞外基质的产生加速肾纤维化的进展,并通过刺激多种细胞因子的表达促进炎症反应。研究者发现,在AngII诱导的小鼠HRD的肾脏组织中,TGF-β1的表达量明显增加,但TRIM31基因缺失并不影响TGF-β1的表达。同时,TGF-β1可直接抑制TRIM31的蛋白表达,提示AngII对TRIM31的蛋白表达调控可能是通过TGF-β1实现的。继之,研究者在HK2细胞中敲减和过表达TRIM31后发现,TRIM31对hTGF-β1刺激下肾小管上皮细胞具有保护作用,且与其E3泛素连接酶的功能密切相关。TGF-β1下游信号通路包括经典Smad信号通路和非Smad信号通路。研究者发现,TRIM31基因缺失同时介导了TGF-β1下游经典Smad信号通路和非Smad信号通路(尤其是NF-κB 和 MAPKs 信号通路)的活化。

为了深入揭示TRIM31作用的分子机制,研究者进一步寻找了TGF-β1信号通路中与TRIM31发生作用的靶蛋白。研究者利用体外翻译系统和Co-IP实验证明,TRIM31可直接作用结合于MAP3K7,TRIM31的130-425氨基酸片段与MAP3K7的1-300氨基酸片段是TRIM31与MAP3K7相结合的氨基酸区域。研究者进一步发现,TRIM31可通过蛋白酶体途径特异性降解MAP3K7,该降解作用依赖于TRIM31的E3泛素连接酶活性。以上结果提示,MAP3K7可能是TGF-β1信号通路中TRIM31调控的特异性靶分子。蛋白的泛素化修饰主要包括K6、K11、K27、K29、K33、K48和K63七种类型,K48位的泛素化修饰常涉及蛋白酶体途径的降解。研究者通过体内和体外泛素化实验发现,TRIM31可介导MAP3K7蛋白的K48位的泛素化修饰,而MAP3K7的第72位赖氨酸残基是TRIM31对MAP3K7进行K48位泛素化修饰的位点。

研究者的以上实验发现,TRIM31可负向调控TGF-β1介导的经典Smad信号通路和MAPKs/NF-kB信号通路,其作用机制是直接降解蛋白激酶MAP3K7,但MAP3K7是否同时调控经典Smad信号通路和MAPKs/NF-kB信号通路进而影响肾小管上皮细胞功能仍不明确,因此研究者利用抑制剂5z7以及小干扰RNA抑制MAP3K7的活性或表达后发现,MAP3K7同时参与调控TGF-β1介导的经典Smad信号通路和MAPKs/NF-kB信号通路的活化,提示TRIM31对MAP3K7 的特异性降解在TGF-β1介导的肾小管上皮细胞的炎症及纤维化过程中可能具有重要作用。同时,研究者检测了HRD患者的肾脏活检组织,发现MAP3K7蛋白表达与患者HRD的进展存在密切联系,进一步提示,TRIM31通过靶向泛素化修饰及降解MAP3K7在HRD中发挥着关键调控作用。

总之,该研究证明,在HRD发生和发展过程中,肾脏中TGF-β1表达升高,抑制TRIM31的表达,进而减少MAP3K7的蛋白降解,通过过度激活的Smad 信号通路和MAPK/NF-kB信号通路,促进肾脏的纤维化及炎症反应。这些结果揭示了高血压肾病发生和发展的新机制,为HRD的治疗提供了新的靶点。
该论文的第一作者是山东大学齐鲁医院心内科博士后张杰,山东大学齐鲁医院张猛教授、张运院士和山东大学基础医学院高成江教授为该论文的共同通讯作者。山东大学齐鲁医院为第一和通讯作者单位。
原文链接:
https://www.nature.com/articles/s41418-021-00874-0

