【本站讯】近日,教育部和国家卫健委心血管重构与功能研究重点实验室张澄教授团队在心血管疾病基础研究中取得系列重大进展,在《科学转化医学》(Science Translational Medicine)、《氧化还原生物学》(Redox biology)、《治疗诊断学》(Theranostics)等国际一流专业期刊连续发表多篇研究论文,受到国际学术界的高度关注。
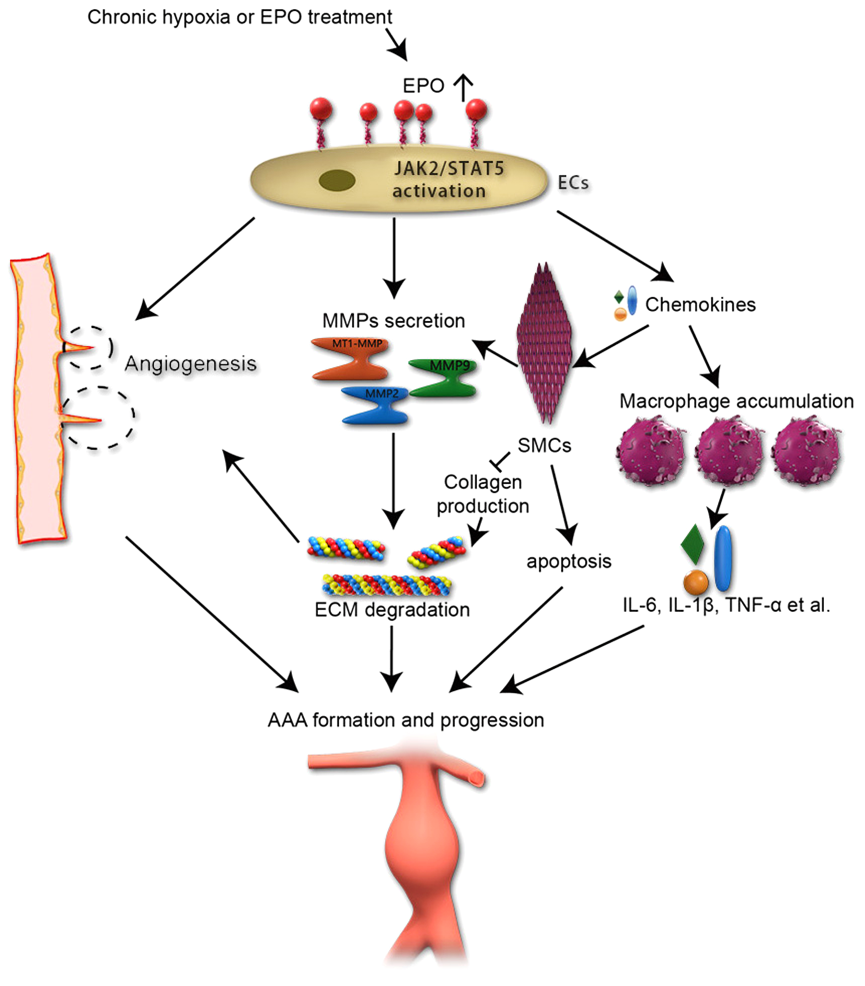
腹主动脉瘤(AAA)是一种潜在的致命性大血管疾病,一旦发生破裂,死亡率高达85%-90%。然而,AAA的发病机制一直未明,导致治疗药物的缺如。建立与人类AAA近似的动物模型,是进行AAA基础研究的前提。目前,Daugherty教授发明的血管紧张素II(Ang II)注射模型是最常用的AAA小鼠模型。然而,该模型必须使用高胆固醇血症的小鼠和超高剂量的Ang II,与临床疾病差距较大,由此得出的干预靶点临床试验无效。心内科博士生章萌在研究中首次发现,促红细胞生成素(EPO)不仅可剂量依赖性地诱导ApoE-/-小鼠发生AAA,同样可诱导野生型小鼠发生AAA,尤其在高剂量EPO组,二者AAA的发生率相似,从而建立了一个与人类AAA更为相似的动物模型。在课题组专家指导下,章萌对该模型的病理和发病机制进行了深入研究,发现EPO诱导的AAA中出现了血管新生、炎症浸润、细胞外基质降解、胶原合成减少、平滑肌细胞凋亡和夹层内血栓形成等病理过程,与人类AAA的病理改变极为相似。体外和离体实验表明,EPO通过JAK2/STAT5信号通路诱导内皮细胞的增殖、迁移和小管形成。临床研究发现,AAA患者的血清EPO浓度显著高于健康个体,并与AAA的大小高度相关。该研究成果提示,血清EPO在AAA发生和发展中起到了重要作用。临床上EPO主要用于治疗慢性肾功能衰竭或恶性肿瘤继发重度贫血的病人,对于需要长期EPO治疗的患者,应定期监测AAA的发生。此外,对生活在高海拔地区或处于慢性缺氧环境的人群,由于血清EPO水平升高,应定期进行AAA的筛查。在治疗学方面,针对EPO/EPOR相关信号通路的干预,有可能成为防治AAA的重要靶标。2021年7月22日,本研究成果发表在国际著名期刊《科学转化医学》(Science Translational Medicine)上,该刊是国际著名杂志《科学》(Science)的重要子刊,中科院1区期刊,最新影响因子17.956,国内外媒体对此原创性成果进行了大量报道。山东大学齐鲁医院为第一和通讯作者单位,齐鲁医院心内科章萌医师为该论文的第一作者,张澄教授、张运院士和张猛教授为共同通讯作者(Pubmed 链接https://pubmed.ncbi.nlm.nih.gov/34290056/)。
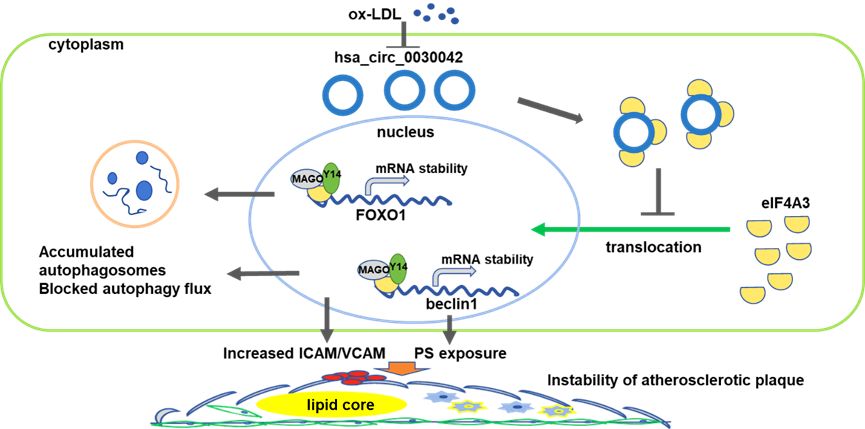
张澄教授团队近期发表的第二项研究成果涉及环状RNA(circRNA)调节细胞自噬和血管内皮功能的作用和机制。环状RNA是区别于传统线性RNA的一类新型RNA,具有闭合环状结构,大量存在于真核转录组中。circRNA作为新型调控型长链非编码RNA,在自噬调控中的作用逐渐显现,但circRNA在冠心病发病中的作用尚未明了。张澄教授课题组在冠心病和对照组受试者中采集外周血样本,采用高通量测序获得了冠心病相关的circRNA差异表达谱,并通过染色质免疫共沉淀及原位杂交等技术,发现在血管内皮细胞中冠心病相关的circ0030042可通过竞争性吸附RNA结合蛋白eIF4A3,影响eIF4A3与下游beclin1和FOXO1的mRNA相结合,降低自噬促进基因beclin1和FOXO1 mRNA稳定性,进而发挥抑制自噬的作用。在ApoE-/-小鼠体内研究中,circ0030042可减少动脉粥样硬化斑块的脂质面积,改善血管内皮依赖性舒张功能,增加斑块的稳定性。体外研究中,高浓度的氧化低密度脂蛋白可激活内皮细胞的异常自噬,导致内皮细胞死亡,而circ_0030042可抑制这一过程。该研究为动脉粥样硬化性心血管疾病的干预提供了新的靶点,论文发表于Theranostics,中科院1区期刊,最新影响因子11.556。山东大学齐鲁医院为第一和通讯作者单位,齐鲁医院心内科于方璞医师为第一作者,张澄教授为通讯作者(Pubmed链接:https://pubmed.ncbi.nlm.nih.gov/33859754/)。
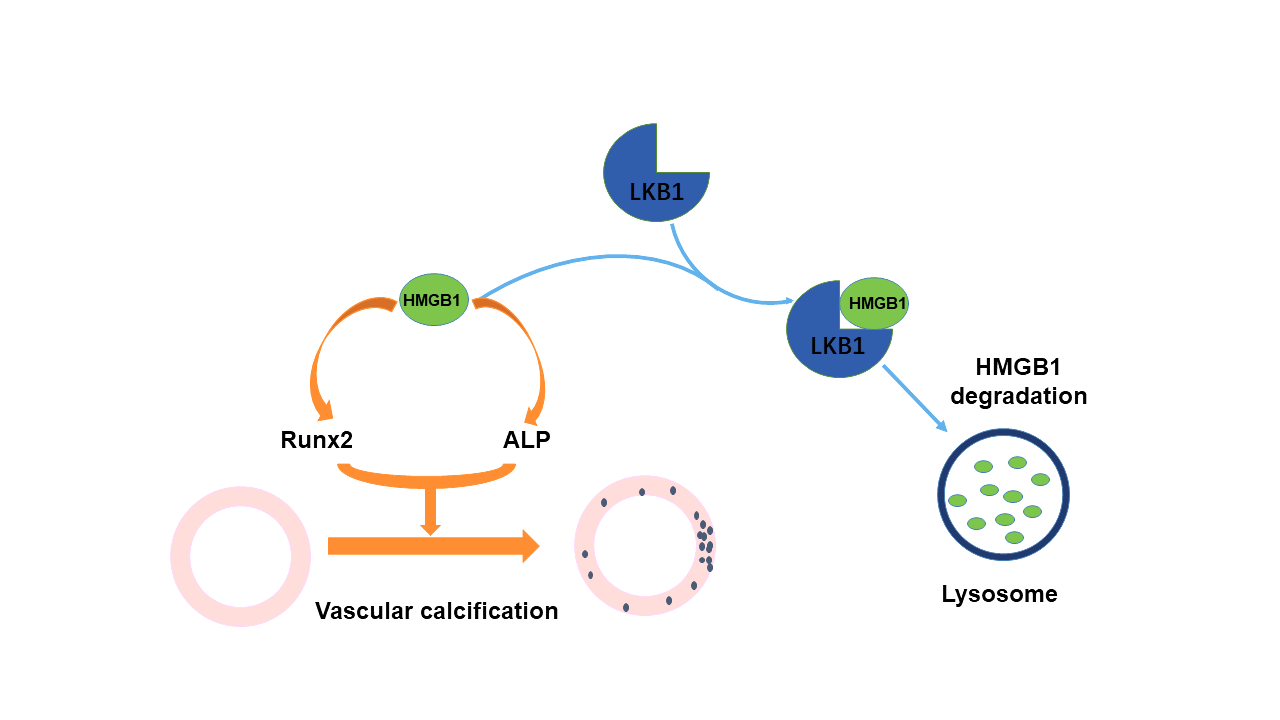
张澄教授团队近期发表的第三项研究成果涉及血管钙化的发生机制。血管钙化常见于动脉粥样硬化,病理学表现为血管组织中钙和磷的过度沉积,导致血管僵硬度升高和斑块不稳定,进而诱发心肌梗死和缺血性脑卒中。目前认为,血管钙化是一种可干预的主动性病理过程,而血管平滑肌细胞向成骨细胞的转化是最重要的发病环节,主要表现为平滑肌特异性基因(如α-SMA和SM22等)的表达下降和成骨性特异性基因(如Runx2、Msx2、ALP等)的表达上调。由于多种因素可参与血管钙化的进程,血管钙化的具体机制仍未阐明。LKB1是一种重要的蛋白激酶,可直接磷酸化并激活AMPK家族,从而发挥多种生物学功能。心血管实验室张文程教授的前期研究发现,在小鼠中敲除LKB1基因可升高血压、促进血管新生和肿瘤发生和诱发腹主动脉瘤,论文分别发表在Circulation、Oncogene和J Mol Cell Cardiol等国际著名杂志,但LKB1在血管钙化中的作用尚无报道。张文程教授和张澄教授领导的课题组成功构建了血管平滑肌细胞LKB1基因特异性敲除小鼠,发现在维生素D诱导的血管钙化模型中,LKB1敲除明显促进了小鼠血管钙化的程度,而LKB1过表达则显著抑制了高磷对血管平滑肌钙化的诱导作用。深入研究发现, LKB1可与高迁移率族蛋白B1直接结合,并通过溶酶体途径促进其降解,从而抑制血管钙化。临床研究证实,与正常人群相比,血管钙化患者组织中LKB1的水平明显下降。该研究进一步阐明了血管钙化的发病机制,证实了LKB1可抑制血管平滑肌的钙化,为临床预防和治疗血管钙化提供了一个新的干预靶点。该研究发表于《氧化还原生物学》(Redox biology)杂志,中科院1区期刊,最新影响因子11.799,山东大学齐鲁医院为第一和通讯作者单位,心内科博士生张天然为第一作者,张文程教授和张澄教授为共同通讯作者(PUBMED链接:https://pubmed.ncbi.nlm.nih.gov/33338919/)。
【作者:隋文海 来源:心血管实验室 责编:李小诗 审核:李宁】

